Uno de los químicos más importantes del siglo XX (si no el que más) ha sido Linus Pauling. No hay libro de química en el que no aparezca su nombre, muchas veces en más de un concepto diferente: desde la teoría de enlace-valencia a las electronegatividades, pasando por el descubrimiento de la estructura tanto de proteínas como de multitud de minerales inorgánicos. Sus contribuciones son no solo innumerables, sino también en muchas ocasiones realmente significativas para el avance del conocimiento. En toda su trayectoria, si hay una virtud que ha caracterizado gran parte de su trabajo, es su capacidad para simplificar problemas realmente complejos, lo que le permitía abordarlos y resolverlos.
Como he comentado, algunas de las más importantes contribuciones de Pauling se han centrado en estudios de tipo cristalográfico. De hecho, su tesis doctoral, defendida en junio de 1925, se centró en la determinación de las estructuras cristalinas mediante difracción de rayos X de una serie de compuestos inorgánicos más o menos sencillos.
Después de
presentar su tesis, viajó a Europa donde estuvo en contacto con los padres de
la física cuántica, que se estaba desarrollando en esa época. En 1927, vuelve
de Europa y consigue una plaza en Caltech, donde además de en el enlace químico,
vuelve a trabajar en la determinación de estructuras cristalinas.
En 1928 decidió abordar un problema de gran complejidad, especialmente en esa época pre-ordenadores, donde todos los cálculos se realizaban de forma manual. Se dedicó al estudio de la estructura de los silicatos, tales como topacio, mica o talco.
Sabía que esos silicatos tenían estructuras que contenían una serie de unidades básicas que se repetían, unidades que estaban formadas por decenas de átomos. Teniendo en cuenta que los cálculos eran manuales, evidentemente era un problema de gran complejidad y prácticamente inabordable en la época. Así que, aplicando su gran intuición para simplificar problemas complejos, Pauling invirtió la aproximación. Es decir, pasó a construir la estructura de abajo a arriba, comenzando por considerar pequeñas piezas básicas para formar las estructuras más complejas.
Para construirlas, conocía cuáles eran los átomos implicados. Generalmente, silicio, oxígeno, muchas veces aluminio, y algún otro metal (M) como magnesio o bien un no metal como flúor. Por aquella época, uno de los padres de la difracción de rayos X,
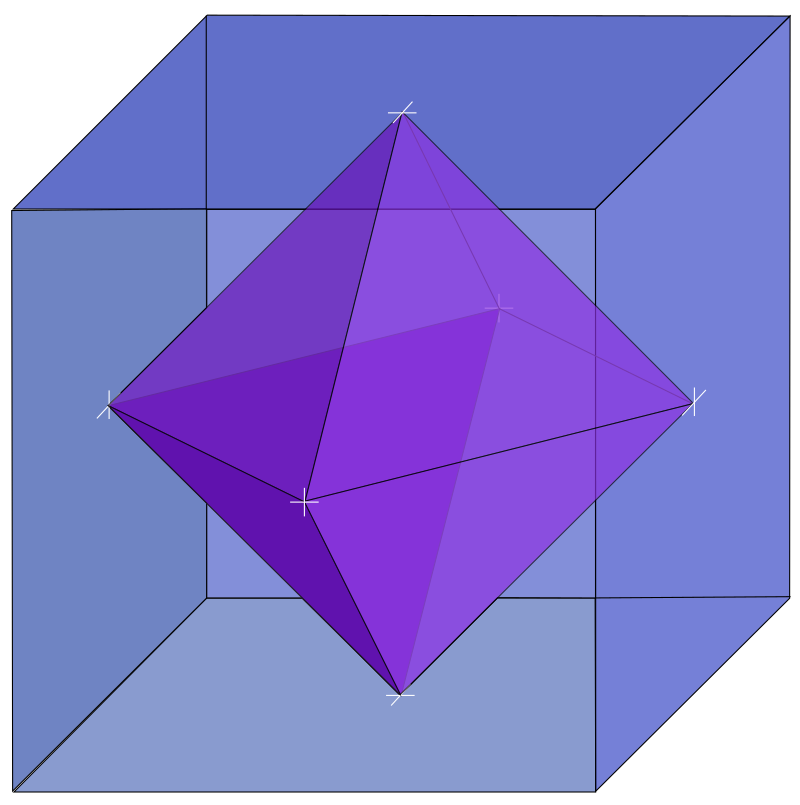
William Lawrence Bragg, también estaba estudiando las estructuras de los silicatos. Bragg imaginó una estructura donde O, Si y M eran canicas en una caja. Colocaba O y Si en la caja, como canicas de gran tamaño, y los M, más pequeñas en los huecos. Esta idea tan gráfica le gustó a Pauling, pero también se dio cuenta del error que conllevaba. Bragg era físico y obvió la química del silicato. Es decir, los átomos no se colocaban independientemente como las canicas de su modelo, sino que se enlazaban entre ellos de formas muy concretas y siguiendo proporciones específicas. Ahí Pauling supo ver que el Si se debería unirse a otros cuatro átomos, en este caso de oxígeno, formando un tetraedro con el silicio en el centro:
También sabía que los oxígenos formaban octaedros en los cristales (podemos imaginarlo como un cubo donde hay un oxígeno en el centro de cada cara).
Es decir, en lugar de canicas en una caja como proponía Bragg, Pauling empezó a pensar en tetraedros y octaedros, es decir, en pirámides y cubos. Una vez que tuvo claras esas mínimas unidades básicas, pasó a idear cómo unirlas. Es decir, podrían compartir aristas, caras o vértices.
Teniendo en cuenta estas ideas sencillas, pasó a una segunda fase. Junto con su esposa, Ava Helen, se dedicaron a construir modelos tridimensionales de esas unidades básicas. Es decir, se dedicaron a recortar papel para construir esos octaedros y tetraedros que luego habría que unir entre sí. Podían así ver qué composición encajaba y cuál no, y probar nuevos cambios con facilidad. Una vez construida una estructura que en principio parecía razonable, se comprobaba si era compatible o no con el patrón de difracción de rayos X .
Para construir los modelos usaron una serie de reglas, que actualmente conocemos como reglas de Pauling. Los tamaños de los átomos e iones que formaban la estructura debían tener mantener proporciones conocidas (datos de los que se disponía previamente). Las longitudes y posiciones de los enlaces debían correlacionarse bien con la cristalografía de rayos X de moléculas más simples, las cargas debían estar balanceadas, etc. Iba añadiendo reglas según iba considerando que debían tenerse en cuenta, como el número de bloques que comparten aristas o vértices.
La genialidad de Pauling fue convertir un problema tan complejo como resolver a estructura de un silicato en una especie de juego, con reglas químicas que aplicaban para determinar la manera en la que se iban construyendo estructuras razonables, que luego finalmente se comprobaban con el patrón de difracción de rayos X obtenido. Así consiguió resolver las estructuras de silicatos como el topacio. Este fue su primer triunfo científico, que lo convirtió, a los 27 años, en uno de los cristalógrafos más reconocidos de su tiempo. El trabajo en el cual presenta las reglas para la construcción de estructuras así como la propuesta de estructura de compuestos como el topacio, Al
2SiO
4(F,OH)
2, fue publicado en
el Journal of the American Chemical Society.
De hecho, aún a día de hoy, las estructuras de los silicatos suelen representarse en base a las unidades básicas que hace casi un siglo propuso Pauling, como en el siguiente ejemplo correspondiente a un silicato de la familia de la mica:
Esta entrada se ha creado para participar en Café Hypatia con el tema #PVcomplejidades








Comentarios
Me alegro de que te haya gustado